
Николай Дмитриевич Бетенеков
Избранные главы курса Радиохимия
Редактор академик РАН Б.Ф. Мясоедов
Рекомендовано методическим советом УрФУ для студентов, обучающихся по направлению подготовки 250900 – Химимческая технология материалов современной энергетики
Рецензенты:
Московский государственный университет, д.х.н., профессор, член. – корр. РАН Мелихов И.В.
Декан химфака МГУ, зав. каф. Радиохимии, д.х.н., профессор, член. – корр. РАН Калмыков С.Н.
Ответственный секретарь журнала РАН Радиохимия, д.х.н., профессор Сидоренко Г.В.
Институт физической химии и электрохимии имени А.Н. Фрумкина Российской академии наук, д.х.н., профессор, член-корр. РАН Тананаев И.Г.
Заведующий кафедрой физической и коллоидной химии УрФУ, д.х.н., профессор Марков В.Ф.
1. Физико-химические особенности состояния и поведения вещества в микроконцентрациях в водных растворах
1.1. Значение микро концентрационного уровня растворов в общей и прикладной радиохимии
Понятие и границы микро концентрационного уровня. Значение микро концентрационного уровня растворов в общей и прикладной радиохимии: особенности поведения радионуклидов-микрокомпонентов в водных растворах. Формы состояния радионуклидов-микрокомпонентов в водных растворах.
Понятие микро концентрационного уровня вещества используется достаточно широко, но строгого определения, а особенно численного значения, которое позволило бы ту или иную примесь отнести к микро примесям или определить содержание, как микро концентрации, нет. Мы можем выдвинуть несколько оснований, которые позволили бы отнести тот или иной компонент к микрокомпонентам.
1. Содержание (концентрация) данного компонента в изучаемой системе. Это самое доступное и тривиальное определение, но его недостатком будет являться то, что отнесение компонента к микрокомпоненту в этом случае будет зависеть от уровня развития аналитической химии.
2. Влияние на свойства системы. Это основание получило свое развитие с развитием тонкой химической технологии, получением особо чистых веществ. В природе абсолютно чистых веществ не существует. Появление абсолютно чистого вещества сразу же вызвало бы возникновение самопроизвольно и необратимо протекающего интенсивного процесса растворения в этом веществе компонентов окружающей среды и ее примесей. Существуют примеси, присутствие которых в микро концентрациях влияет на макро свойства объекта: полупроводники, фосфоры и т. д. В этом случае задача может быть двоякой. С одной стороны, необходимо получение особо чистого вещества, а с другой – возникает необходимость строго дозированного введения примеси.
3. Аномалии собственного поведения вещества в микро количествах в физических и физико-химических процессах. В технологии получения особо чистых веществ они (т. е. особо чистые вещества) рассматриваются как предельно разбавленные растворы примесей, которые характеризуются тем, что межмолекулярное (межионное) взаимодействие сохраняется только между основными компонентами и микро примесями. Ионы и молекулы микро примесей хаотически распределяются в макрокомпоненте и полностью сольватируются с максимальным координационным числом. Поэтому дальнейшее разбавление не изменяет энергии взаимодействия молекулы микро примеси с окружающими ее молекулами основного компонента. Понятие микро примесь и соответствует достижению такого предельного разбавления. Взаимодействие ионов и молекул микро примеси В с молекулами растворителя А, находящимся не только в непосредственном окружении, но и в удаленных объемах раствора, приводит к известной нейтрализации ионных и молекулярных полей микрокомпонентов. Поэтому реакция

сдвинута влево, и вероятность образования между примесями химических соединений или ассоциатов (В-В) в результате крайне редких соударений сольватированных частиц (А-В) ничтожно мала.
Свои определения понятия микрокомпонента можно дать и применительно к особенностям поведения в некоторых процессах. Например, в процессе осаждения из водных растворов микрокомпонент можно определить как вещество, присутствующее в растворе, которое при обычных условиях не осаждается из-за низкой концентрации или высокой растворимости. (В противоположность, макрокомпонент – вещество, содержащееся в растворе в такой концентрации, что его можно осадить добавление соответствующих компонентов.) Ясно, что такое определение не дает определенной границы, позволяющей отнести ту или иную примесь к микрокомпоненту, но позволяет утверждать, что в конкретном физико-химическом процессе и в определенных условиях примесь ведет себя как микрокомпонент. Этому подходу соответствует и определение микрокомпонента, как вещества, подчиняющегося закону Генри в процессах межфазного распределения.
Проблема поведения микро примесей традиционно решалась в рамках радиохимии. Это явилось, прежде всего, следствием того, что радиометрический метод является простым и доступным методом, позволяющим следить за поведением микрокомпонентов в сложных системах, особенно в тех случаях, когда другие аналитические методы имеют концентрационные ограничения или, в случае определения микро количеств, отличаются трудоемкостью или являются малодоступными.
Например, удельная активность Ra-224 (Т1/2 = 3,66 сут., Е = 5,686 МэВ) составляет 370 кБк/л, что более, чем достаточно для регистрации, но концентрация радия составляет 2,8·10-13 моль/л.
Присутствие в растворе радионуклидов может вызвать изменение состава раствора, что связано не только с влиянием ионизирующих излучений, что будет рассмотрено далее в части, посвященной химическому действию излучений, но и с появлением в результате радиоактивного распада других стабильных и радионуклидов. Например, существует раствор CaCl2 концентрации 1 г/л, содержащий SrCl2 с концентрацией 10-3 г/л. Как будет изменяться состав раствора со временем? В идеальном случае – он будет оставаться постоянным. Если в растворе присутствует вместо Sr изотоп 90Sr, то, даже не оценивая возможность осуществления радиационно-химических процессов, ясно, что в результате радиоактивного распада
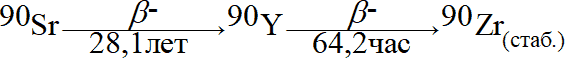
в растворе будет накапливаться цирконий, химические и физико-химические свойства которого кардинально отличаются от свойств стронция, а концентрация которого будет изменяться со временем (рис. 1.1.). Наступит момент, когда накопившийся цирконий станет влиять на свойства системы в целом, что невозможно не учитывать.

Рис. 1.1. Изменение состава раствора Sr-90 активностью 1 Ku/мл.
Исторически аномальное поведение микроколичеств вещества прежде всего было отмечено при изучении свойств таких элементов, как Tl, Pb, Bi, Po, Ra (членов природных радиоактивных семейств) при концентрациях 10-8 – 10-14 моль/л. Наблюдались аномалии двух видов: «исчезновение» из растворов и «неподчинение» основным закономерностям, характерным для поведения макроколичеств этих элементов в особенно в процессах межфазного распределения – сокристаллизации, соосаждения, экстракции, сорбции и других. Эти аномалии поведения микрокомпонентов необходимо учитывать не только при решении исследовательских и аналитических задач, но и при разработке технологии извлечения, концентрировании и других технологических проблем.
Бурное развитие радиохимии было связано с решением военных и энергетических задач, актуальность которых в определенные периоды времени была определяющей. Например, для разработки технологии выделения плутония из ядерного топлива в 1943 г. в распоряжении исследователей было всего 0,5 мг Pu. Коэффициент перехода от лабораторной разработки до промышленной установки составил 1010. В условиях мирного времени подобного не сделал бы ни один здравомыслящий ученый или инженер. Одной из составляющих ядерного топливного цикла является переработка облученного ядерного топлива. Цель переработки облученного ядерного топлива может быть различной. Она может заключаться в выделении неразделившегося урана, вторичного ядерного топлива (изотопов плутония), некоторых продуктов деления, представляющих интерес. Сложность этой задачи становится очевидной, если проанализировать состав облученного ядерного топлива, приведенный в таблице 1.
Таблица 1.1.
Состав раствора, полученного при растворении 1000 кг урана с глубиной выгорания до 1000 МВт∙сут/т, время выдержки – 100 сут.

Основные научные направления кафедры радиохимии связаны с физико-химией гетерогенных систем, синтезом специфических и селективных неорганических сорбентов с заранее заданными свойствами и теорией межфазного распределения растворенных веществ:
• Изучение закономерностей межфазного переноса радионуклидов из растворов различного происхождения в фазу неорганических сорбентов;
• Исследование состояния радиоактивных микрокомпонентов в водных растворах природного и техногенного происхождения.
Вклад в теорию межфазного распределения радионуклидов-микрокомпонентов сделан в основном трудами Ю. В. Егорова, Н. Д. Бетенекова, В. Д. Пузако, В. В. Кафтайлова, Е. В. Полякова и Т. А. Недобух. Эта задача в настоящее время интересует не только технологов и аналитиков, но и геохимиков, специалистов в области прикладной экологии, токсикологии и др. Приемы концентрирования и разделения веществ, находящихся в разбавленных и сложных по составу растворах, являются основными операциями современных технологий, так как именно эти процессы (концентрирование, выделение и разделение) определяют успешность обезвреживания отходов, переработки многокомпонентного (полиметаллического) сырья, технологии особо чистых веществ и материалов с точно дозированными примесями. Учеными кафедры разработан теоpетический анализ влияния истинно– и псевдоколлоидных фоpм соpбата на закономеpности статики и кинетики сорбции. С использованием методов соpбции, электpофоpеза, ультpафильтpации с пpименением ядеpных фильтpов и ультpацентpифугиpования исследованы фоpмы состояния радиоактивных микpокомпонентов в различных pаствоpах (пpесные воды, моpская вода и хлоpидно-натpиевые гидpотеpмы).
Таким образом, изучение и учет физико-химического поведения микрокомпонентов в сложных системах является не только чисто исследовательской проблемой, но и затрагивает технологические разработки, а для решения экологических задач может стать определяющим.
Состояние микрокомпонентов в водных растворах
Под термином «состояние» в радиохимии подразумевается совокупность всех форм, образованных радионуклидом в водном растворе:
а) простые акваионы – M(H2O)Nz+;
б) ионные пары или внешнесферные комплексы;
в) комплексные ионы, образованные центральным ионом (Мz+) и лигандами (Ln-), причем лиганды могут быть одинаковой или различной химической природы – {M(H2O)N-iLi}z-ni;
г) моноядерные продукты гидролиза {M(H2O)N-i(OH)i}z-i;
д) полиядерные гидроксокомплексы – {Mj(H2O)j(N-i)(OH)i}jz-i;
е) гетерополиядерные гидроксокомплексы;
ж) истинные радиоколлоиды;
з) псевдорадиоколлоиды.
Знание форм состояния радионуклидов чрезвычайно важно, так как они определяют поведение радионуклида в любых технологических операциях (сокристаллизация, соосаждение, сорбция, ионный обмен, экстракция, электролиз и т. п.). Поэтому представляют интерес расчетные методы, позволяющие на основании справочных данных получить предварительную оценку концентрации (или доли) каждой из возможных форм состояния радионуклида в растворе конкретного состава.
1.2. Ионо-дисперсное состояние микрокомпонентов в растворах. Комплексные соединения
Комплексные (координационные) соединения. Устойчивость координационных соединений. Внутрикомплексные (хелатные) соединения. Лиганды. Дентатность лиганда. Монодентатные и полидентатные лиганды. Устойчивость внутрикомплексых соединений. Размер хелатного цикла. Хелатный эффект.
К ионно-дисперсным формам относятся простые акваионы, моноядерные, полиядерные и гетрополиядерные комплексы.
Описание ионодисперсных форм обычно осуществляют с позиций образования комплексных соединений.
Комплексные соединения или, другими словами, координационные соединения – это частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому 'комплексообразователем' (центральным атомом), нейтральных молекул или других ионов, называемых лигандами. Для комплексного соединения характерно то, что он сохраняется как самостоятельная единица даже в растворе, хотя может происходить и частичная диссоциация. Комплекс может быть нейтральной частицей или иметь положительный или отрицательный заряд в зависимости от заряда центрального атома и координированных групп – лигандов. В растворе простые ионы не существуют, они образуют с молекулами растворителя сольватные (для водных растворов – акво-) комплексы. Молекулы растворителя более или менее прочно связаны с ионами, молекулы первой сольватной оболочки расположены вокруг иона в определенном порядке. Количество и расположение молекул растворителя вокруг центрального атома определяется объемом иона, плотностью заряда на нем и пространственными условиями. Следовательно, реакцию образования комплексов в растворе можно рассматривать как реакцию обмена молекул растворителя на молекулы лигандов:
, (1.1)
М – центральный ион, L – лиганд (органический или неорганический ион или нейтральная молекула), заряды для простоты опущены.
В процессе комплексообразования молекулы растворителя, окружающие центральный ион могут последовательно замещаться ионами или молекулами лиганда, что в итоге приводит к образованию комплекса MLn, где n – число лигандов в комплексе. Это число равно координационному числу, если лиганды образуют с центральным ионом только одну связь. Координационное число зависит от природы лиганда, поэтому к приписыванию данному центральному иону одного определенного координационного числа следует относиться с осторожностью. Классический подход к определению структуры координационных соединений заключался в том, чтобы установить структуру неизвестного соединения на основе структур известных изомеров. Структуры плоского квадрата, тетраэдра и октаэдра (рис. 1.2.), приписанные соединениям, были подтверждены физико-химическими методами. Хотя наиболее часто встречаются координационные числа 6 или 4, известны соединения, в которых центральный ион имеет координационное число вплоть до 10–12.
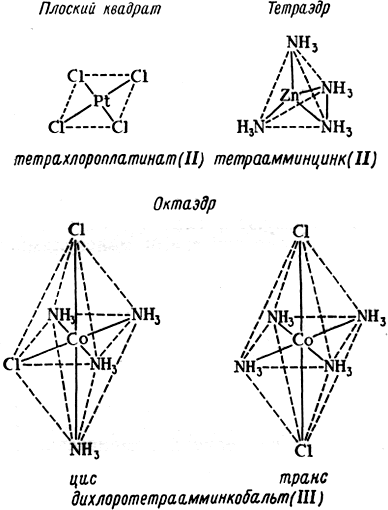
Рис. 1.2. Образование комплексов различной структуры [1].
Равновесия реакций комплексообразования
В общем случае образование комплексного соединения можно выразить следующим уравнением:
, (1.2)
тогда термодинамическая константа комплексообразования:
, (1.3)
где aM= f[M] – активность, f – коэффициент активности, [ ] – символ концентрации. Согласно теории Дебая-Хюккеля, коэффициенты активности в разбавленных растворах в первом приближении определяются только ионной силой раствора и могут быть рассчитаны по уравнению Дэвиса [2].
При постоянной ионной силе J = const концентрационная константа β отличается от термодинамической константы βt при J = 0 на постоянную величину, поэтому
. (1.4)
Если в структуре комплекса существует только один центральный атом, то он называется моноядерным, если m ≠ 1, то полиядерным. Хотя полиядерные комплексы встречаются также часто, как и моноядерные, в большинстве случаев их образованием пренебрегают, особенно при низких концентрациях.
Комплексы обычно образуются ступенчато, процесс характеризуется ступенчатыми константами комплексообразования Ki:
(1.5)
Проведя подстановки: 
получаем  , (1.6)
, (1.6)
где βN – общая константа образования (устойчивости). В данном выражении N – число присоединенных лигандов, а не координационное число. Если рассматривать обратный процесс, то получаем реакцию диссоциации, которая характеризуется константой диссоциации или нестойкости k:
(1.7)
Константы нестойкости ступенчатые – обратные величины ступенчатым константам устойчивости. Общая константа нестойкости
. (1.8)
Для определения констант и описания форм состояния ионов в растворе имеют большое значение соотношения между константами и аналитически измеряемыми величинами. Общая концентрация металла в растворе в виде свободного иона и комплексных частиц определяется уравнением:
. (1.9)
Введя  получаем
получаем
 N – максимальное число лигандов в комплексе.
N – максимальное число лигандов в комплексе.
Общую концентрацию лиганда можно определить:
(1.10)
Для определения степени закомплексованности Нильс Бьеррум предложил использовать среднее координационное или лигандное число, которое при заданных концентрации лиганда и константах устойчивости комплекса характеризует глубину комплексообразования. Среднее лигандное число и дает число лигандов, связанных с одним ионом металла – комплексообразователя во всех типах комплексов, т.е

Подставив соответствующие выражения, получаем:
(1.11)
При заданных βi среднее лигандное число зависит только от концентрации лиганда и не зависит от концентрации металла в растворе (рис. 1.3). Это утверждение справедливо только для случая образования моноядерных комплексов. Если CL>>CM, то [L] ≈ CL. Когда CL<1 °CM, то при расчете нельзя пренебрегать связанным в комплекс лигандом.

Рис. 1.3. Изменение среднего лигандного числа в зависимости от концентрации лиганда для цианидных комплексов кадмия [1].
Еще одна величина, которая нашла широкое применение, – это мольная доля i– комплекса в растворе αi.
. (1.12)
Из определения следует  αiзависят только от концентрации лиганда и не зависят от концентрации металла в растворе (рис. 1.4).
αiзависят только от концентрации лиганда и не зависят от концентрации металла в растворе (рис. 1.4).

Рис. 1.4. Доля аммиачных комплексов цинка, как функция концентрации свободного аммиака [2].
При такой концентрации лиганда, при которой один из комплексов присутствует в максимальных количествах (αi=max), n̄соответствует числу лигандов, связанных в этом комплексе. Абсциссы точек пересечения кривых мольных долей, т. е. точек, в которых концентрации двух последовательных комплексов одинаковы, равны отрицательным логарифмам ступенчатых констант устойчивости:
(1.13)
Если ион металла образует комплексы с несколькими видами лигандов, то распределение по формам можно рассчитать аналогично:
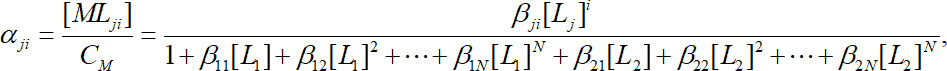 или в общем случае
или в общем случае
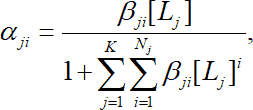 (1.14)
(1.14)
где К – число различных видов лигандов, участвующих в комплексообразовании (рис. 1.5).
Равновесия образования полиядерных комплексов рассмотрим в части, посвященной процессам гидролиза.
Внешнесферные и внутрисферные комплексы
Приведенные уравнения и константы характеризуют процесс образования внутрисферного комплекса в результате проявления сил близкодействия, что приводит к молекулярному контакту между ионом-комплексообразователем и лигандами. Если лиганды способны образовывать вторую и более удаленные сферы, то говорят об образовании внешнесферных комплексов. Возможность образования внутрисферного комплекса определяется напряженностью поля и способностью к поляризации, следовательно, зарядом и радиусом иона, т. е. ионным потенциалом  , где z – заряд иона, а r – его радиус.
, где z – заряд иона, а r – его радиус.

Рис. 1.5. Состояние урана (VI) в морской воде в зависимости от рН: 1 – UO2F+; 2 – UO2SO4; 3 – UO22+; 4 – UO2Cl+; 5 – UO2(SO4)22-; 6 – UO2F3-; 7 – UO2OH+; 8 – UO2(OH)2; 9 – UO2(CO3)22-; 10 – UO2(CO)34- [13].
Координирующая способность растет с увеличением ионного потенциала центрального иона. Образование внешнесферного комплекса происходит по типу образования ионных пар. Например, аномальная величина ионного потенциала Li обуславливает его наибольшую поляризующую способность и наименьшую поляризуемость среди всех щелочных металлов. В поле, которое создает Li+ происходит процесс структурирования воды: молекулы воды, которые представляют собой диполи, ориентируются в поле Li+, образуя внутреннюю и внешние сферы (рис. 1.6).

Рис. 1.6. Процесс структурирования воды в поле Li+.
В водном растворе в результате этого литий имеет наибольший радиус, что объясняет его меньшую подвижностьпо сравнению с подвижностью ионов калия и натрия. По величине гидратированного иона лития (10 Å) можно вычислить, что в первой сфере он имеет – 6, во второй – 30, а в третьей – 76 молекул воды, что естественно, оказывает определяющее влияние на его химические свойства и физико-химическое поведение в водных растворах.
Внешнесферные комплексы могут быть идентифицированы по изменению некоторых характеристик, в частности, спектральных. Для лабильных систем (когда лиганды, входящие в состав внутренней и внешней сфер, могут легко меняться местами) трудно провести различие между внешнесферными и внутрисферными комплексами. Возможно, превращение внешнесферного комплекса во внутрисферный происходит в результате химической реакции
(1.14)
скорость которой определяется скоростью образования ионной пары и, в дальнейшем, внутрисферного комплекса. Возможность перехода одной формы комплекса в другую характеризует лабильность комплекса. Оказывается, что комплексы трехвалентных РЗЭ чрезвычайно лабильны. Причина этого, по-видимому, в большом координационном числе ионов РЗЭ. Скорость определяющей реакцией будет удаление молекулы воды из внутренней координационной сферы и ее замещение на лиганды второй внешней координационной сферы.




