
Алексей Макарушин
Парадоксы эволюции. Как наличие ресурсов и отсутствие внешних угроз приводит к самоуничтожению вида и что мы можем с этим сделать
Жизнь бактерий в архейном замке
Работа их наследников – митохондрий – в сущности сохранила принципиальную схему выработки энергии, предполагаемую для первичных форм жизни в морских подводных щелочных гидротермальных источниках:
1. Наличие источника протонов (ионов водорода) и/или ионов натрия – для первичных форм жизни это окружающая среда: богатая протонами (то есть кислая) и соленая (то есть богатая натрием) морская вода или соленая вода закрытых озер; в митохондриях это узкое пространство между наружной и внутренней мембранами митохондрий. Сюда изнутри митохондрий выталкивает протоны цепь белковых комплексов, расположенных на внутренней мембране. Выталкивание происходит за счет движения электронов по этой цепи – так называемой дыхательной или электрон-транспортной цепи (ЭТЦ). Электроны и протоны берутся из происходящего внутри митохондрий цикла ферментативных реакций (цикла Кребса), полностью, до углекислого газа и воды, разлагающего пируват – продукт распада глюкозы в гликолизе. Электроны по ЭТЦ движутся к своему «приемному пункту» – конечному акцептору электронов, окислителю. Реакции приема-передачи электронов соответственно называются окислительно-восстановительными. У животных конечным приемщиком (акцептором) электронов служит кислород, но есть одноклеточные (например, некоторые бактерии), у которых электроны принимаются серой, нитратами, железом и другими веществами.
2. Наличие бедной протонами (то есть щелочной) среды – для первичных форм жизни это щелочная вода источников, в митохондриях это внутренний матрикс с ферментами цикла Кребса, откуда по ЭТЦ наружу выкачиваются протоны.
3. Наличие полупроницаемой мембраны между указанными выше средами. Полупроницаемая – это значит, что для прохождения через нее вещества должны потратить энергию или совершить работу (или, как обычно бывает в жизни, кто-то должен сделать это за них). В данном случае работа может совершаться за счет разницы концентраций протонов или натрия по разные стороны мембраны (что и образует уже названные протонный или натриевый потенциалы). Для первичных форм жизни мембраны могли быть неорганические, например серпентинитовые, с каталитическими железосерными кластерами, для современных форм жизни характерны липидные, в которые встроены многочисленные каталитические белки – ферменты, включая белки ЭТЦ. По сути, как говорилось, сам по себе потенциал уже является формой энергии. В развитых формах жизни этот потенциал «заряжает» универсальный биологический аккумулятор, то есть благодаря ему на окончании цепочки ЭТЦ в процессе упомянутого окислительного фосфорилирования образуется АТФ из АДФ. Для первичных форм жизни вопрос транспорта электронов учеными еще не решен: его постоянный направленный механизм обязан был существовать, чтобы обеспечить образование первичных, самых простых органических молекул, например из углекислого газа, самого распространенного во все времена источника углерода. Но что стало самым первым источником электронов – восстановителем – в цепи реакций, в результате которой могли бы образовываться хотя бы самые простые органические молекулы: метан, формальдегид, цианид и им подобные простые вещества? Теоретически им мог стать тот же молекулярный водород Н2, но практически пока не удается продемонстрировать реальность подобной реакции. Известный ученый и популяризатор науки Ник Лейн (2015) очень упорно, но, как многим представляется, недостаточно убедительно, настаивает, что подходящие условия для вовлечения водорода в эту реакцию могли возникнуть именно в щелочных гидротермальных источниках с участием железосерных кластеров. Других приличных вариантов первичного запуска транспорта электронов в любом случае пока еще нет. Для нас же важна уверенность многих ученых, что в любом случае эволюция живого от первых до-жизненных форм до сложившихся клеток происходила в щелочных термальных источниках или в непосредственной связи с ними, сохраняя на этом отрезке развития общие принципы получения, удержания и использования энергии.
Когда приблизительно 1,5–2 миллиарда лет назад бактериальные предки митохондрий начали свой переезд в живой «замок» древней археи, они, разумеется, прихватили вместе с собой весь свой небогатый скарб: не ахти какой, но все-таки своеобразный биологический «капитал» – свой наследственный материал.
Но со временем необходимость поддержания стабильности «главного» генома археи (а по факту – уже общей наследственности) предопределила перемещение и почти всего митохондриального генома во вновь возникшее ядро – ризницу хранения священного наследственного материала в главном соборе усложнившегося архейного-эукариотического замка (БОН: глава VII). Однако проблемы качественного управления на месте (гемба-менеджмента) заставили несколько последних генов (у человека – 13 генов белков, 22 транспортных РНК и 2 рибосомальных РНК) до конца оставаться непосредственно в самих митохондриях. В конечном счете та же необходимость уменьшения митохондриальной гетероплазмии, то есть спонтанно возникающего в жестких биохимических условиях внутриклеточной водородной «электростанции» чрезмерного разнообразия генов – «локальных производственных процедур», совершенно логическим образом вызвало возникновение двух полов с наследованием родительского ядерного материала в пропорции 50 на 50 %, и со 100 % наследованием митохондриального генома от одного материнского родителя. Практически любой сбой в согласованной работе между митохондриальными генами, локализованными в ядре, и локализованными в митохондрионе ведет к падению эффективности работы электрон-транспортной цепи (ЭТЦ), что проявляется увеличением образования активных форм кислорода (АФК), и, соответственно, итоговым уменьшением образования АТФ. Если рассогласованность имеет постоянный характер, это, согласно модифицированной свободнорадикальной теории старения, увеличивает скорость старения и сокращает продолжительность жизни особи (Lane N., 2015).
Опираясь на представление о стержневой роли митохондрий в энергетическом обеспечении как эволюции сложных организмов, так и развития – от рождения до смерти – отдельного организма, можно увидеть глубочайшую вовлеченность митохондрий во все физиологические процессы организма. В своей тяжелейшей и наиболее очевидной форме для человека это проявляется в виде так называемых митохондриальных заболеваний, но участие митохондриона неизбежно просвечивается и во множестве других, самых неожиданных феноменах других патологий.
Когда они ломаются
Собственно, митохондриальными заболеваниями (МЗ) в узком смысле называют болезни, непосредственно связанные с дефектами дыхательной (электрон-транспортной) цепи (ЭТЦ), то есть процесса окислительного фосфорилирования. Например, синдром Лея (Leigh syndrome) – подострая некротизирующая энцефаломиелопатия вследствие появления в стволе мозга, мозжечке, базальных ганглиях очагов некроза, глиоза, прорастания сосудов, проявляющаяся задержкой или даже регрессией психомоторного развития, мышечной гипотонией, на что впоследствии накладываются самые разнообразные психосоматические нарушения, вплоть до судорожных припадков. Связана с функциональной дисфункцией крупных молекул I или IV комплекса ЭТЦ и/или дисфункцией малой молекулы – цитохрома С. МЗ возникают вследствие наследственных или спонтанных мутаций в митохондриальной ДНК (мтДНК) или в ДНК ядерных генов, контролирующих работу митохондрий. Сейчас известно более 300 таких возможных мутаций, затрагивающих около 100 генов. Остаются тем не менее случаи с явной клиникой митохондриальных заболеваний, но без выявленных генетических нарушений. Как правило, МЗ затрагивают только отдельные типы клеток в определенных органах и тканях, преимущественно (но далеко не всегда) с высокими энергетическими потребностями, такими как нервная и мышечная ткани. Тем не менее узкая поражаемость во многих случаях только определенных органов, как, например, оптическая нейропатия Лебера (Leber Hereditary Optic Atrophy, LHON), при которой повреждаются только ганглиозные клетки сетчатки глаза, все еще требует более точного объяснения. Возможно, более системные нарушения митохондриальной функции останавливают жизнь организма еще на уровне первых делений оплодотворенной яйцеклетки, а для реализации скрытых нарушений, которые приводят к органоспецифичным МЗ, требуются существенные ко-факторы, скорее приобретенные, чем наследуемые.
Дополнительным объяснением может быть как раз то, что митохондрии – не столько «маленькие энергетические станции» клетки, а ключевые фигуранты практически всего клеточного метаболизма, в том числе узкоспециализированного для определенных клеток и тканей, а также коммутаторы обмена информацией как внутри клетки, так и вовне, включая коммуникации с другими симбионтами организма, такими, какими когда-то были их предки. В конце концов вполне можно представить (БОН: глава VII), что это не архейная клетка милостиво соблаговолить изволила впустить митохондриальных предков в свой богатый внутренний мир за «мзду малую» ради взаимовыгодного сожительства-симбиоза (бывает ли когда сожительство равно взаимовыгодным?), но предки митохондрий сами пришли и взяли свое по «праву сильного». И до сих пор их наследники, несмотря на свою малость и невзрачность, держат ключевые пути метаболизма и коммуникаций всей единой клетки и всего единого организма в своих руках.
В работе митохондрий задействовано около 3000 генов из порядка 22 000 генов человека. Из них чуть больше 100 генов (3 %) кодируют белки ЭТЦ. И только 13 из них, обеспечивающих самую быструю реакцию, остались в самой митохондрии. Остальные 97 % митохондриальных белков, преимущественно ферментов, обеспечивают во всех клетках окисление белков, жиров и углеводов, метаболизм холестерина, эстрогенов и тестостерона, дифференцировку и специализацию клеток, а в уже специализированных клетках – выполнение ключевых операций их узкого функционала.
Например, в эндокринных клетках – выработку большинства нейротрансмиттеров, в клетках печени – реакции детоксикации, в предшественниках эритроцитов – синтез гема. Даже функциональность иммунных клеток, например цитотоксических Т-лимфоцитов, определяется их уровнем митохондриальной белковой трансляции, где митохондрии оказываются ранее недооцененными гомеостатическими регуляторами их цитотоксичности (Lisci M. et al., 2021). Перечень функций белков, работающих в митохондриях, пусть и закодированных в генах ядерных хромосом, этим перечнем, разумеется, далеко не ограничивается.
Непреклонная воля
Дикий прапор из фильма «ДМБ», если бы проводил экскурсию молодым солдатам-молекулам по многочисленным криптам-закоулкам митохондрии, показал бы как минимум четыре места «откуда, ребятки, наша митохондрия диктует свою непреклонную волю остальному клеточному сообществу».
1. Белок цитохром С – одна из небольших, но важных шестеренок ЭТЦ. Однако при выпадении из цепи она становится «черной меткой» для всей клетки: активирует каскад ферментов-каспаз, заканчивающийся организованной (запрограммированной) смертью всей клетки – апоптозом (Liu X. et al., 1996).
2. Промежутки между основными белковым комплексами ЭТЦ. Отсюда, как снопы искр из-под вагонных тележек, выскакивают активные формы кислорода (АФК: например перекись водорода, супероксид-анион, гидроксил). Через окисление тиоловых групп в промежуточных белках они активируют факторы транскрипции ключевых групп генов, определяющих функциональный статус всей клетки (Chandel N.S. et al., 1998).
3. Фермент 5’АМФ-активируемая протеинкиназа (AMP-activated protein kinase, AMPK) – регулятор энергетического статуса клетки. Контролирует слияние митохондрий в длинные рабочие нити-спагетти при высокой потребности клетки в энергии и распад на мелкие зернышки-орзо (в терминах итальянской пасты, рис. 8), при переходе клетки в экономный режим существования (Herzig Sand Shaw R. J., 2018).
4. Митохондриальная ДНК (мтДНК). Когда находится внутри митохондрии, выполняет естественную функцию хранилища последних митохондриальных генов. Но при попадании в цитозоль у некоторых иммунных (миелоидных) клеток запускает особую последовательность молекулярных взаимодействий, так называемый ДНК-чувствительный cGAS – STING сигнальный путь. Этот путь отлично работает при разрушении, например, чужеродной ДНК вирусов. Но в случае мтДНК иммунная клетка идет дальше и переходит в состояние готовности немедленно начать воспалительную реакцию даже в отсутствии вредоносного вируса-патогена. Одновременно запускает формирование сложных многобелковых воспалительных комплексов – инфламмасом (West A. P. and Shadel G. S., 2017).
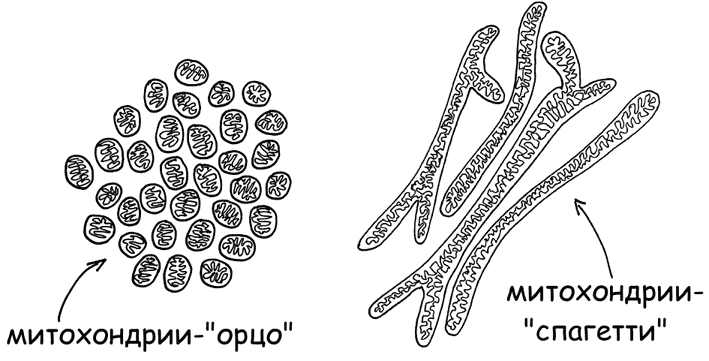
Рис. 8. Митохондрии в форме орзо и спагетти
Инмакулада Мартинез-Рейз и Навдип Чандел (Inmaculada Martinez-Reyes and Navdeep Chandel, 2020) из Медицинской Школы Северо-Западного Университета в Чикаго считают, что эти четыре механизма власти митохондрий можно дополнить еще и пятым, через который также определяется жизнь и судьба, но уже не столько самой клетки, а всего организма. Этот пятый механизм непосредственно влияет на иммунную систему, включая его возможности защититься от инфекций и опухолевого перерождения. Сердцем этого механизма является уже упоминавшийся цикл Кребса, или цикл трикарбоновых кислот (у которых основной «скелет» составляют три атома углерода). Это своего рода центральная карусель во всеобщем метаболическом парке развлечений любой сложной клетки располагается именно в митохондриях. На ней без остановок катаются девять непрестанно взаимопревращающихся трикарбоновых кислот. Эту карусель вращают непрерывно заскакивающие на нее пируват и ацетил-коэнзим А, и соскакивающие с нее восстановительные эквиваленты. Соскочив, они несут свои атомы водорода, как игровые бонусы, прямиком в кассу ЭТЦ, чтобы обменять на универсальную и доступную всем энергетическую валюту АТФ. Но катающиеся на карусели органические кислоты тоже могут иногда соскакивать с карусели и начать разруливать сложные проблемы в парке обмена веществ и во всем организме.
Так, лимонная кислота может выйти из митохондрии через свою особую дверь – декарбоксилатный антипортер А1 25-го семейства переносчиков растворенных веществ SLC25A1 (хорошо, что ей при выходе не нужно называть весь этот пароль). Оказавшись в цитозоле или ядре, она с помощью специального фермента ACLY превращается в ацетил-коэнзим А (митохондриальный ацетил-коэнзим А из самой митохондрии, увы, просто так не выпускают – он должен непрерывно «вращать карусель»).
В ядре ацетил-коэнзим А может ацетилировать хроматин. Это вообще-то его основная задача – ацетилировать все, что нужно (то есть прикреплять к другим молекулам остаток уксусной кислоты – ацетата). Но ацетилирование хроматина – белкового комплекса из гистонов, вокруг которого закручена вся ядерная ДНК, – имеет далеко идущие последствия. Это одна из форм изменения так называемой эпигенетической наследственности, то есть способа включения и выключения определенных генов, не связанного с изменением собственно нуклеотидной последовательности ДНК (другая форма, например метилирование самой ДНК). Так как большинство генов регуляторные, то частичное ацетилирование хроматина изменяет профиль экспрессии генов – часть генов тормозится, часть, наоборот, активируется в зависимости от наличия и уровня множества других специальных факторов транскрипции (запуска генов).
В любом случае даже небольшое изменение содержание ацетил-коэнзима А в ядре ведет к значительной перестройке работы всей генетической программы клетки (Sivanand S., Viney I., Wellen K. E., 2018), преимущественно в сторону ускорения реакций роста и размножения (анаболизма и пролиферации). Такая полная и быстрая перестройка через ацетилирование хроматина исключительно важна для согласованной работы ключевых клеток иммунной системы – макрофагов, Т-лимфоцитов. В них, с учетом всей поступившей информации (информационного контекста, БОН: глава XII) – в первую очередь о возможности бактериального присутствия (по уровню липополисахарида, ЛПС), о предпочтительности активного, воспалительного типа реагирования (по уровню провоспалительных факторов транскрипции STAT и нуклеарного фактора каппа NF-κB) – повышается уровень ACLY, лимонная кислота из митохондрий мобилизируется в ядро и цитоплазму, где превращается в ацетил-коэнзим А, ядерный хроматин ацетилируется и запускается программа ускоренного размножения и выработки молекул воспаления, включая АФК, оксид азота и простагландины макрофагами (Infantino V. et al., 2013), γ-интерферона Т-лимфоцитами (Peng M. et al., 2016).
Модуляторы иммунитета и опухолевого роста
Подобный путь поддержки роста и размножения активно работает и во многих опухолевых клетках. Искусственное торможение фермента ACLY в опухолевых клетках может задерживать их рост (Hatzivassiliou G. et al., 2005), но, к сожалению, в плане практического применения этот способ пока трудноосуществим. Также с возможностью опухолевого перерождения клетки связано накопление в ядре и цитоплазме двух других кислот с митохондриальной трикарбоновой карусели – фумаровой и янтарной (фумарата и сукцината). Как правило, это вызывается неблагоприятными мутациями в генах обслуживающих их ферментов-дегидрогеназ. Появление и накопление этих кислот в ядре вызывает гиперметилирование ДНК и хроматина. А поскольку это формы эпигенетического изменения наследственности, то в клетке также изменяется и реализация генетической программы в сторону опухолевого типа метаболизма (Niemann S. and Muller U., 2000; Sciacovelli M. et al., 2016). Вообще, признав митохондрии краеугольным камнем эволюции сложной жизни, неким гарантом энергетической и информационной целостности сложных многоклеточных организмов, нетрудно представить, что они несут определенную ответственность и за распад этой целостности в случае злокачественных опухолей. Рассмотрению этого вопроса будет посвящен основной раздел предпоследней главы этой книги.
В нормальных физиологических условиях метаболиты цикла Кребса функционируют как модуляторы иммунитета. Янтарная кислота скорее поддерживает развитие воспаления (Tannahill G. et al., 2013; Littlewood-Evans A. et a.l, 2016), хотя на макрофаги, особенно в некоторых тканях, например жировой, янтарная кислота действует противовоспалительно (Keiran N. et al., 2019) Торможение воспаления фумаровой кислотой, особенно в слегка измененной, но физиологической форме диметилфумаровой кислоты еще более выражено (O’Neill L. A., Kishton R. J. and Rathmell J., 2016). Вообще, близкие родственники (производные) трикарбоновых кислот с митохондриальной карусели, как правило, еще более активны. Так, итаконовая (метилен-янтарная) кислота обладает очень выраженными иммуномодулирующими и антибактериальными свойствами. Своим действием она уравновешивает провоспалительные эффекты янтарной кислоты, а также способна «перекрывать кран» с углеводами организма для многих бактерий-паразитов. Также крайне разносторонними эффектами на иммунную систему обладает трикарбоновая альфа-кетоглутаровая кислота (α-КГ). Она влияет и на эпигенетику клетки: не расставляет, как ацетил-коэнзим А, ацетиловые метки на хроматине, а убирает метиловые метки, расставленные, например, S-аденозилметионином. В особенности активна производная от α-КГ – 2-гидроксиглутаровая кислота. Она способна ключевым образом влиять на дифференцировку иммунных Т-клеток с помощью аналогичных эпигенетических механизмов (Xu T. et al., 2017). И, пожалуй, самое главное, что большинство из названных факторов конструируют специфический эпигенетический ландшафт неадаптивных иммунных клеток при формировании «тренированного иммунитета» (БОН: глава XII).
Располагая таким внушительным арсеналом определяющих воздействий на состояние всей клетки и даже влияя на функциональный статус всей совокупности клеток – всего организма, митохондрион не может быть простым пассивным топливным элементом клетки; очевидно, что именно он ведущий игрок в сложной внутриклеточной игре, определяющий функциональный потенциал и в целом судьбу как «своей» клетки, так и, во многом, всего организма. Но является ли он лишь одним из ведущих игроков, разделяя дуумвират или триумвират, например с ядром и/или хлоропластами (в растительной клетке), или обладает безусловным лидерством, подчиняя остальных своим интересам? Ответ может лежать у самых оснований жизни и эволюции, на зыбкой границе термодинамики, квантовой физики и физической химии.


